6月10日,先声药业(2096.HK)与G1 Therapeutics, INC.(Nasdaq:GTHX)合作开发的创新药Trilaciclib(COSELATM)关于三阴性乳腺癌的临床试验申请获得国家药品监督管理局批准。
先声将加入G1 公司开展的包括中国在内的Trilaciclib三阴性乳腺癌III期临床研究,以支持该适应证在中国的获批。该研究是一项随机、双盲、国际多中心临床研究,旨在评价Trilaciclib 或安慰剂在一线或二线接受吉西他滨和卡铂化疗的不可切除局部晚期或转移性三阴性乳腺癌患者中疗效。这是继广泛期小细胞肺癌(ES-SCLC)和转移性结直肠癌(mCRC)两项骨髓保护适应证III期临床试验获批后,Trilaciclib在国内的第三项适应证获批临床。
三阴性乳腺癌:治疗选择少,预后差
最新全球癌症负担数据显示,2020年,乳腺癌新发人数达226万,取代肺癌成为全球第一大癌症1。三阴性乳腺癌(Triple-Negative Breast Cancer, TNBC)是雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER-2)均为阴性的乳腺癌亚型,约占15~20%,是一种具有高度侵袭性的肿瘤。
由于缺乏有效靶点,相较于其他类型的乳腺癌,三阴性乳腺癌在治疗选择上受到限制,无法对现有的激素治疗药物及靶向HER-2蛋白受体药物产生反应,化疗仍是目前主要的治疗手段。
然而,化疗药物会受到毒性的限制,可能导致患者发生耐药。此外,化疗引起的骨髓抑制还会损伤患者的免疫细胞,使免疫系统无法有效地产生抗癌应答。
时至今日,三阴性乳腺癌仍没有突破性的治疗手段出现,患者有着巨大的未被满足的治疗需求。寻求具有更佳抗肿瘤疗效,又不引起高度毒性的新的治疗手段成为了该领域探索的焦点。
海外Ⅱ期临床:改善患者生存获益
在G1已经完成的 Ⅱ期临床试验(G1T28-04)中,Trilaciclib与化疗联合使用时,对三阴性乳腺癌患者的生存获益有临床意义上的改善。G1T28-04是一项全球多中心、随机、开放标签的Ⅱ期研究,用于评价Trilaciclib联合吉西他滨+卡铂治疗转移性三阴性乳腺癌患者疗效、安全性和药代动力学(PK)。该试验将 102 名经治或未经治患者随机分配到3个治疗组,在为期21天的治疗周期接受单纯化疗或联合Trilaciclib治疗。
组1:单纯化疗组(吉西他滨/卡铂)
组2:化疗当日接受Trilaciclib
组3:化疗当日及前日接受Trilaciclib
研究的关键主要终点是第1周期严重中性粒细胞减少症的持续时间以及整个治疗期间严重中性粒细胞减少症的发生情况,关键次要终点为总生存期(OS)。结果显示,在第1周期,3组患者在严重中性粒细胞减少的平均持续时间和发生率上没有显著差异。虽然这一主要终点为阴性,但化疗联合Trilaciclib组患者的总生存期却显示出了具有统计学意义的改善。
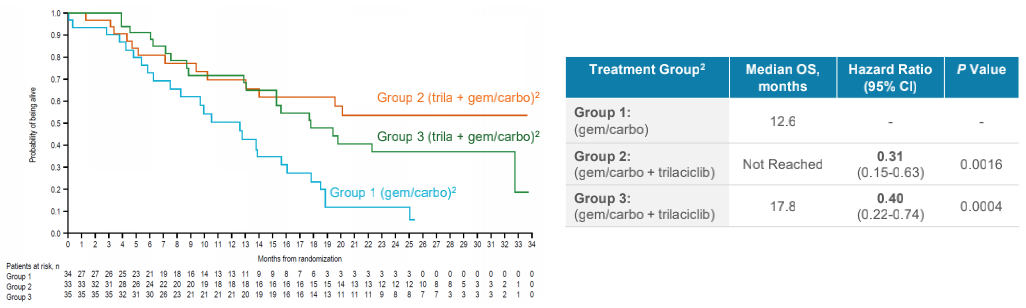
意向治疗分析(ITT)人群总生存期(OS)²
至数据截止日期(2020年7月17日),单纯化疗组患者的中位总生存期为 12.6 个月,化疗当日接受Trilaciclib组未达中位生存期,化疗当日及前日接受Trilaciclib组为 17.8 个月。第 2 组和第 3 组的中位总生存期为19.8 个月(HR=0.37,p<0.0001)。
除了对总生存期的显著影响外, 还观察到Trilaciclib对无进展生存期(PFS)和客观缓解率(ORR)的改善。
进一步的亚组分析表明, 不同CDK4/6 状态的患者总生存期相似。与单纯化疗组相比,联合治疗组 PD-L1 阳性和 PD-L1 阴性患者的 OS 均有所延长,其中 PD-L1 阳性亚群实现了统计学上的显著改善。
基于该项临床试验的结果,G1 公司已于今年启动了Trilaciclib在三阴性乳腺癌的Ⅲ期注册临床研究。
近年来,中国乳腺癌的发病率在持续增高,先声药业也将快速推进Trilaciclib在中国三阴性乳腺癌患者的临床试验,为患者提供更佳的治疗选择。
关于Trilaciclib
Trilaciclib(商品名:COSELATM)为G1 Therapeutics, INC.开发的一款高效、选择性、可逆性细胞周期蛋白依赖性激酶 4/6(CDK4/6)抑制剂,在化疗导致的骨髓抑制适应证中为一款“First-in-Class”疗法。在广泛小细胞肺癌患者中进行三项包含随机对照部分的关键性临床研究中,Trilaciclib在降低不同化疗引起的骨髓抑制方面展示了显著的预防性作用。其稳健、显著的保护骨髓的优势被美国FDA认可,并授予突破性治疗认定和优先审评资格。Trilaciclib于今年3月被纳入两项美国国家综合癌症网络(NCCN)指南(《小细胞肺癌(V3)》及《造血因子(V2)》)。
除小细胞肺癌外,G1公司于2021年启动了Trilaciclib在三阴性乳腺癌及转移性结直肠癌(mCRC)的两项Ⅲ期注册性临床试验,关于乳腺癌新辅助化疗、非小细胞肺癌二线治疗以及膀胱癌一线治疗的探索性研究也正在境外进行中。
2020年8月,先声药业与G1 Therapeutics, INC.达成合作协议,负责Trilaciclib在大中华地区(中国大陆、香港、澳门和台湾)所有适应证的开发和商业化。
参考资料来源:
1.世界卫生组织国际癌症研究机构(IARC)
2.O'Shaughnessy et al., 2020 San Antonio Breast Cancer Symposium (SABCS), Poster #PD1-06.
素材来源:先声药业