一、政策简讯
1、5月14日国家药监局发布关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告
文件要求,已上市的化学药品注射剂仿制药,未按照与原研药品质量和疗效一致原则审批的品种均需开展一致性评价。药品上市许可持有人应当依据国家药品监督管理局发布的《仿制药参比制剂目录》选择参比制剂,并开展一致性评价研发申报。目前已有153个注射剂品种已有企业递交一致性评价补充申请,而在已过评的33个注射剂里,当前注射用培美曲塞二钠、氟比洛芬酯注射液、右美托咪定注射液、注射用紫杉醇白蛋白已经纳入国家带量采购。
2、5月15日,国家药监局药品审评中心发布《关于公开征求《药品说明书和标签管理规定》(修订稿)意见的通知》
药审中心对《药品说明书和标签管理规定》及其细则进行完善,形成征求意见稿,现向社会各界公开征求意见。据了解,药品说明书和标签管理规定(修订稿)新增了14个条款,修订了2个条款。主要修订的内容是强化持有人是药品说明书和标签的责任主体,负责药品说明书和标签的制定、修订和维护,另外,增加了“按假药”处罚的部分。
3、第三轮国家集采 即将开始
5月15日上海医药集中招标采购事务管理所召开会议,会议内容主要与国家集采相关工作有关,此前负责国家集采工作的相关人士参与了会议。根据国家2020医药招采文件,相关部门将加强过一致性评价药品竞争态势分析,研究提出适合于集中带量采购产品的清单与产品特点分析。
二、药企动态
1、诺和诺德未来创新药在中国同步提交审批
4月27日,诺和诺德宣布启动“中国同创”计划。该项目是诺和诺德推动中国加入全球同步临床研究,实现从临床试验到新药递交申请全球同步的具体操作指南,旨在加速创新产品在中国的研发和注册。“中国同创”项目启动后,将加速多款创新药于2025年前在中国上市,2025年后90%以上的全球创新药将在中国同步提交审批——这标志着中国在诺和诺德全球研发战略中的重要性已提升到最高级别。诺和诺德从2015年至2019年,已在中国进行了14项临床试验,累计共纳入2,971名患者,投资高达5.45亿元人民币。
2、新增投资1.8亿美元,罗氏诊断深化在华布局
近日,罗氏宣布将进一步加大投资罗氏诊断亚太生产基地和研发中心,拟新增投资总额为1.8亿美元,累计投资总额达4.79亿美元,此次增资将进一步深化罗氏诊断在华的战略布局,也再次印证了罗氏诊断扎根中国,致力于与中国医疗行业共发展,造福中国乃至亚太患者的长期承诺。新增投资将用于包括组织诊断染色平台试剂和专业诊断试剂在内的各个体外诊断试剂生产建设与产品线转移项目。

3、为127个国家供应瑞德西韦 吉利德与5家仿制药生产商达成合作
在瑞德西韦获得美国FDA用于治疗COVID-19的紧急授权后,吉利德一直在寻找合适的合作伙伴以帮助其提高产量。日前,通过与多家仿制药生产商达成许可合作,吉利德已迈出了建立该网络的第一步。5月13日,吉利德科学发布“关于瑞德西韦的自愿授权协议”的公告称,已与5家位于印度和巴基斯坦的仿制药生产商签署了非独占自愿授权协议,以进一步扩大瑞德西韦的供应。该授权允许Cipla Ltd.、Ferozsons Laboratories、Hetero Labs Ltd.、Jubilant Lifesciences 和Mylan公司生产瑞德西韦,并供应至127个国家。
4、沛嘉医疗港股上市
5月15日,沛嘉医疗有限公司(股票代码:9996.HK,以下简称沛嘉医疗)正式挂牌香港联合交易所,成为2020年首个登陆港交所的高端医疗器械公司,沛嘉医疗深耕中国高增长经导管瓣膜治疗及神经介入领域多年,已建立集研发、制造及商业化能力于一体的协同平台,并拥有全面的“心脑同治”产品组合。开盘后,沛嘉医疗即大涨74.48%,报26.8港元。同时,沛嘉医疗公开发售超额认购近1200倍, 冻资额超过2600亿元,华丽登顶今年新股“冻资王”,也成为港交所上市制度改革以来,认购最踊跃的生物科技股。
5、估值近20亿美元传奇生物提交美股上市申请,拟募资1亿美元
5月13日,传奇生物(Legend Biotech)宣布准备在美国证券交易所挂牌交易。传奇生物在不久前完成了pre-IPO轮1.605亿美元融资,投资方有Hudson Bay Capital、强生创投、礼来亚洲基金、维梧资本、RA资本和华润旗下基金华润正大等,投后估值约19.6亿美元。JNJ-4528是一种针对B细胞成熟抗原(BCMA)的细胞疗法,该蛋白是许多血液癌(包括多发性骨髓瘤)中细胞表面大量存在的蛋白质。当前没有针对BCMA的FDA批准的疗法。
6、天士力出资2750万美元引进治疗胰腺癌及黑色素瘤创新药
5月11日,天士力发布公告称,控股子公司天士力生物医药股份有限公司于近日与TakaraBioInc.(日本宝生物工程株式会社)签署了《C-REV许可协议》,天士力生物引进一款治疗胰腺癌及黑色素瘤的溶瘤病毒产品(简称“C-REV”)。该药物治疗胰腺癌的日本一期临床的中期数据已发布,治疗黑色素瘤的二期临床试验已完成。根据协议约定,天士力生物拥有在中国(包括中国大陆、香港及澳门,不包括台湾)排他性的开发、注册、生产和商业化的权益。该创新药物的引进,将进一步拓宽天士力生物肿瘤治疗药物产品管线,有利于天士力生物搭建溶瘤病毒技术平台。
7、罗欣药业借壳上市
5月12日起,东音股份(002793)证券简称将正式更名为“罗欣药业”,罗欣药业正式借壳上市。而东音股份的主营业务发生重大变更,转型进入医药制造行业,主营业务为医药产品的研发、生产和销售。资料显示,之前,东音股份的主营业务为井用潜水泵、小型潜水泵、陆上泵的研发、生产和销售。据公告内容,公司同意将公司中文名称由“浙江东音泵业股份有限公司”变更为“罗欣药业集团股份有限公司”,英文名称由“Zhejiang Doyin Pump Industry Co.,Ltd.” 变更为“Luoxin Pharmaceuticals Group Stock Co., Ltd.”,公司证券简称由 “东音股份”变更为“罗欣药业”。
8、三生国健科创板首发过会
5月11日,上交所发布科创板上市委审议结果,同意三生国健首发上市。三生国健是中国第一批专注于抗体药物的创新型生物医药企业,目前拥有两款已上市治疗性抗体类药物,分别为“重组人型肿瘤坏死因子受体-抗体融合蛋白(商品名“益赛普”)和重组抗CD25人源化单克隆抗体注射液(商品名“健尼哌”)。益赛普于2005年上市,用于治疗类风湿关节炎、强直性脊柱炎和银屑病,是中国首个上市的全人源抗体类药物,也是中国风湿病领域第一个上市的肿瘤坏死因子(TNF-α)抑制剂。
9、格力地产17.25亿入股科华生物,成其第一大股东
近日,格力地产公告称,公司全资子公司珠海保联资产管理拟通过协议方式购买League Agent(HK) Limited (以下简称LAL公司)上海科华生物工程股份有限公司股份。根据公告,本次收购约为5,863,038股股份(占科华生物总股本的18.63%),购买价格为人民币17.25亿元。同时,科华生物方面也发布公告称,此次权益变动完成后,LAL公司不再持有公司股份,珠海保联成为公司第一大股东,公司仍无控股股东、实控人。科华生物是国内一家拥有完整医疗诊断产品的体外诊断公司,于2004年在深圳证券交易所中小板上市。截至2019年12月底,科华生物拥有230余项获国家药品监督管理局NMPA批准的及70个经欧盟CE认证的试剂和仪器产品,自主产品涉及分子诊断、生化诊断、免疫诊断三大领域。
三、药品审批
1、FDA批准Opdivo+Yervoy一线治疗非小细胞肺癌
5月15日,BMS宣布FDA批准Opdivo (nivolumab) 3 mg/kg +Yervoy (ipilimumab) 1 mg/kg用于一线治疗PD-L1阳性(≥1%)、EGFR或ALK阴性的成人转移性非小细胞肺癌(NSCLC)。Opdivo+Yervoy是FDA目前批准的首个且唯一一个肿瘤免疫治疗药物组合,分别靶向作用于PD-1和CTLA4这两个不同的免疫检查点。Opdivo能帮助T细胞发现和杀伤肿瘤细胞,Yervoy则可以刺激T细胞的活化和增殖,并且Yervoy刺激的一些T细胞能够转化为记忆性T细胞,从而使得免疫应答维持更长的时间。
2、FDA批准首个四线晚期胃肠道间质瘤疗法
5月15日,Deciphera Pharmaceuticals公司宣布FDA批准其Qinlock(ripretinib)上市,用于治疗既往接受过伊马替尼、舒尼替尼和瑞戈非尼治疗的晚期胃肠道间质瘤(GIST)患者。Ripretnib的上市申请是根据FDA下属的肿瘤学卓越中心(OCE)的实时肿瘤审评试点项目(RTOR)进行审评,确保在保持和提高审评质量的同时,尽早为患者提供安全有效的治疗。2019年6月,再鼎医药与Deciphera公司达成独家授权协议,获得Ripretinib在大中华区(中国大陆、香港、澳门和台湾)的开发和商业化权益。
3、Inherent获FDA第2个突破性疗法认定
5月11日,阿斯利康/第一三共宣布其Enhertu(trastuzumab deruxtecan)获得FDA授予的突破性疗法认定,用于治疗HER2阳性、不可切除/转移性胃或胃食管交界部腺癌,这些患者先前至少接受过两种治疗方案,包括曲妥珠单抗。第一三共已经于5月7日就该适应症在日本提交上市申请。这是FDA授予Enhertu的第2个突破性疗法认定。2017年,FDA首次授予Enhertu突破性疗法认定,用于治疗HER2+转移性乳腺癌,该适应症已于2019年获得FDA批准。
4、FDA批准近20年来首个卡波西肉瘤新药
5月15日,百时美施贵宝(Bristol Myers Squibb,BMS)宣布,美国FDA加速批准Pomalyst(pomalidomide,泊马度胺)用于治疗与艾滋病相关且对抗逆转录病毒疗法(HAART)耐药的卡波西肉瘤患者,以及HIV阴性的卡波西肉瘤患者。Pomalyst曾获得突破性疗法和孤儿药认定。该口服疗法是20多年来卡波西肉瘤患者的第一个新治疗选择。

5、FDA批准首款获批治疗前列腺癌的PARP抑制剂
近日,Clovis Oncology公司宣布,美国FDA加速批准其PARP抑制剂Rubraca(rucaparib)片剂扩展适应症,用于治疗携带有害BRCA基因突变的转移性去势抵抗性前列腺癌(mCRPC)成人患者,这些患者已经接受了雄激素受体靶向疗法和紫杉烷类化疗。Rubraca是一款口服小分子PARP1、2、3抑制剂。这类靶向疗法通过抑制PARP蛋白介导的DNA损伤修复机制,利用“合成致死”原理,在杀伤肿瘤的同时,不影响健康细胞。
6、Moderna疫苗获FDA快速通道资格
Moderna公司宣布,该公司开发的新冠疫苗mRNA-1273获得FDA授予的快速通道资格。流行病防范创新联盟(CEPI)将追加提供3.88亿美元资金,支持其新冠病毒疫苗NVX-CoV2373的进一步临床开发。根据世界卫生组织的统计,目前已经有8个疫苗研发项目展开了临床试验,而临床前疫苗研发项目超过了100个。
7、赛诺菲单抗疗法获优先审评资格
近日,赛诺菲(Sanofi)公司宣布,美国FDA已授予其靶向补体C1s蛋白的单克隆抗体sutimlimab的生物制品许可申请(BLA)优先审评资格,治疗冷凝集素病(CAD)成人患者。FDA预计将于今年11月13日前做出回复。新闻稿指出,如果获得批准,sutimlimab将成为首款治疗冷凝集素病成人患者溶血的获批疗法。Sutimlimab是一款靶向补体C1s蛋白的单克隆抗体,有望治疗多种自身免疫性疾病。此前,sutimlimab已获得美国FDA授予的突破性疗法资格和孤儿药资格。
8、再鼎肿瘤电场疗法获批上市
5月13日,再鼎医药与Novocure宣布国家药品监督管理局(NMPA)批准肿瘤电场治疗爱普盾®上市,用于与替莫唑胺联用治疗新诊断的胶质母细胞瘤患者的治疗,以及作为单一疗法用于复发胶质母细胞瘤患者的治疗。胶质母细胞瘤是最常见的原发性脑肿瘤,爱普盾是15年来中国内地首个获批用于胶质母细胞瘤的疗法,也是再鼎医药半年内在中国内地获批的第二个产品。
9、诺和诺德利拉鲁肽注射液心血管适应症在中国获批
5月14日,国家药品监督管理局(NMPA)批准了诺和诺德公司研发生产的人胰高血糖素样肽-1(GLP-1)类似物诺和力®(利拉鲁肽注射液)的心血管适应症上市申请。此次获批适应症的具体内容包括:适用于降低伴有心血管疾病的2型糖尿病成人患者的主要心血管不良事件(心血管死亡、非致死性心肌梗死或非致死性卒中)风险。截至5月14日,诺和力®是中国目前唯一具有降低心血管风险适应症的降糖药物。
10、武田维布妥昔单抗在中国获批
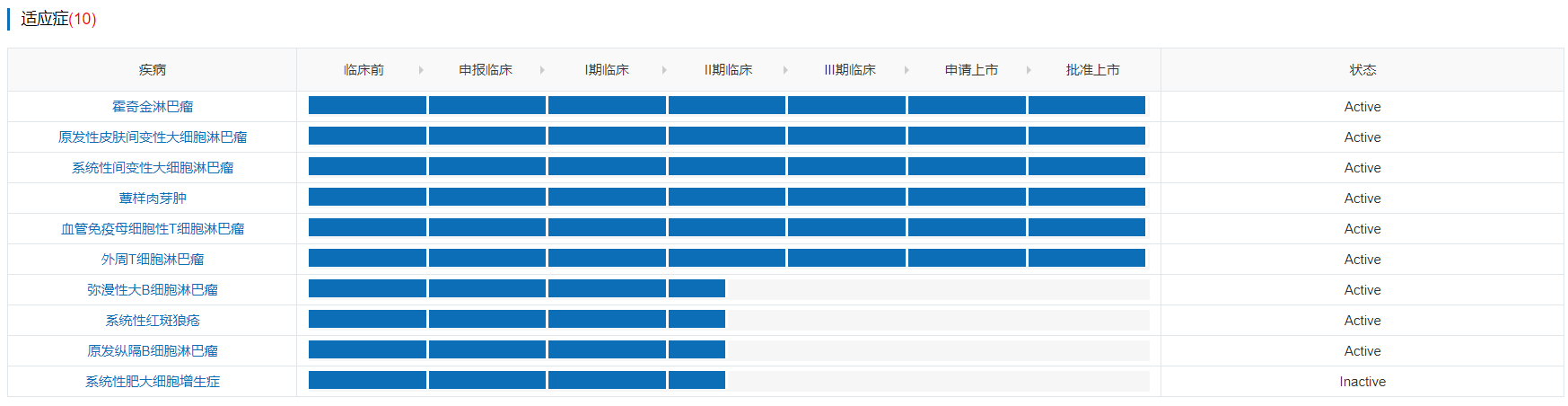
5月14日,武田维布妥昔单抗获得国家药监局批准上市,用于治疗复发性/难治性CD30阳性经典型霍奇金淋巴瘤(cHL)或系统性间变性大细胞淋巴瘤(sALCL)。这是国内获批的第2个抗体–药物偶联物(ADC)。维布妥昔单抗最初于2011/8/19获得FDA批准,目前已经获批6项适应症,包括霍奇金淋巴瘤、原发性皮肤间变性大细胞淋巴瘤、系统性间变性大细胞淋巴瘤、蕈样肉芽肿、血管免疫母细胞性T细胞淋巴瘤和外周T细胞淋巴瘤。2019年,Adcetris全球销售额达11.21亿美元。
11、达格列净心衰适应症中国上市申请拟纳入优先审评
5月13日,阿斯利康在中国提交的达格列净新适应症上市申请拟纳入优先审评,用于射血分数降低的心力衰竭(HFrEF)成人患者,降低心血管死亡和心力衰竭恶化的风险,并改善心力衰竭症状。该适应症刚于5月5日获得FDA批准。达格列净是一种SGLT2抑制剂 ,于2014/1/8获得FDA批准,目前已经在美国获批3项适应症,分别为2型糖尿病,降低2型糖尿病或其他心血管死亡风险患者的心衰住院风险,降低HFrEF患者的心血管原因死亡或心衰恶化风险。
12、罗氏视神经脊髓炎谱系疾病新药satralizumab上市申请获CDE受理
5月15日,国家药品监督管理局正式受理罕见病视神经脊髓炎谱系疾病(NMOSD)治疗药物satralizumab的上市许可申请。罗氏制药已在包括中国在内的全球13个国家及地区递交了Satralizumab的上市许可申请,在2018年12月获得美国食品药品管理局(FDA)突破性疗法认证(BTD),于2019年8月提交上市申请。此外,satralizumab于2016年6月获得欧洲药品管理局(EMA)的孤儿药认证,2019年8月提交了上市申请。Satralizumab在日本的上市申请于2019年11月提交,并获得孤儿药认证和优先审评资格。

四、医药科技
1、IL-8可作为癌症治疗靶标,还能预测预后
近日,来自来自罗氏旗下公司基因泰克以及耶鲁大学医学院分别在《Nature Medicine》发表了两篇题为“High systemic and tumor-associated IL-8 correlates with reduced clinical benefit of PD-L1 blockade”和“Elevated serum interleukin-8 is associated with enhanced intratumor neutrophils and reduced clinical benefit of immune-checkpoint inhibitors”的研究论文,表明循环系统中IL-8的高表达,与免疫检查点抑制剂疗效降低有关,血浆IL-8表达水平可作为免疫检查点抑制剂治疗癌症患者的易于检测的预后生物标志物。
2、刘中华/刘静宇团队在钠通道与疼痛领域取得重要进展
近日,湖南师范大学刘中华教授和华中科技大学/中国科学院神经科学研究所刘静宇教授团队合作,在《Nature Communications》发表题为“Spider venom-derived peptide induces hyperalgesia in Nav1.7 knockout mice by activating Nav1.9 channels”的研究论文。该研究发现一种对电压门控钠通道具有新型作用模式的蜘蛛毒素HpTx1,其抑制Nav1.7、激活 Nav1.9、但不影响 Nav1.8。为Nav1.7相关的先天性无痛症治疗提供了新的策略、新的靶点和药物先导分子
3、T细胞竟是使用蛋白质“炸弹”,实现对危险细胞的杀伤
近日,英国牛津大学等单位的研究人员在《Science》发表题为“Supramolecular attack particles are autonomous killing entities released from cytotoxic T cells”的研究论文。研究团队揭示出杀伤性T细胞攻击“外敌”时的更多新细节,它们会利用具有一层蛋白外壳的超分子攻击粒子(SMAP),并在其核心携带颗粒酶和穿孔素装载致命化学物质的蛋白质“炸弹”轰炸靶细胞。
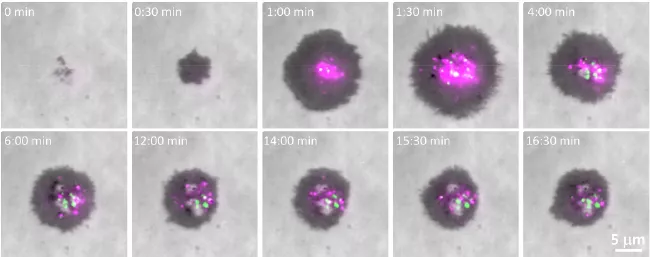
SMAP可以在长达1天内杀死细胞
4、南京鼓楼医院完成世界首例iPS干细胞心脏病治疗,安全有效
日前,南京鼓楼医院王东进团队在《Nature》发表了题为“Revealed: two men in China were first to receive pioneering stem-cell treatment for heart-disease”的论文,在这项研究中,两名中国男子接受了基于“重编程”干细胞的实验性心脏病治疗,并在一年后成功康复。据悉,这是已知的全球首个用于治疗受损心脏的iPS技术的临床应用。
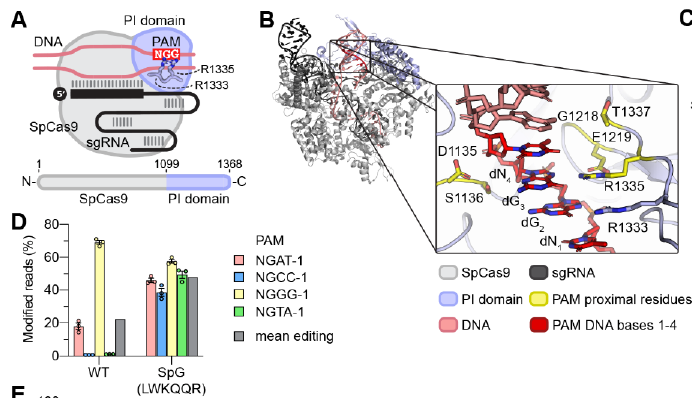
5、哈佛医学院开发出新的Cas9变体,可以靶向基因组绝大部分序列
近期,哈佛医学院Benjamin P. Kleinstiver团队在《Science》发表题为“Unconstrained genome targeting with near-PAMless engineered CRISPR-Cas9 variants”的研究论文,该研究以开发出一种名为SpRY的近PAMless SpCas9变体,SpRY核酸酶和碱基编辑器变体可以靶向几乎所有PAM,在人类细胞中具有NRN PAM的广泛位点上均表现出强大的活性,而对于具有NYN PAM的酶则具有较低但重要的活性。使用SpG和SpRY,该研究生成了以前无法获得的与疾病相关的遗传变异,从而可以在基因组任何序列进行编辑。
能够靶向NGN PAM的SpCas9变体的工程设计和表征(图源自Science)
6、何川/陈建军/钱志坚及张好建发现ALKBH5在急性髓细胞性白血病的关键作用
5月12日,贝克曼研究所陈建军,芝加哥大学何川及佛罗里达大学钱志坚共同通讯在《Cell Stem Cell》发表题为“RNA Demethylase ALKBH5 Selectively Promotes Tumorigenesis and Cancer Stem Cell Self-Renewal in Acute Myeloid Leukemia”的研究论文,研究发现揭示了ALKBH5在白血病发生和LSC / LIC自我更新/维持中的关键功能,并突出了靶向ALKBH5 / m6A轴的治疗潜力。
7、新研究成功地从小鼠胚胎中培育成熟人类细胞
日前,来自布法罗大学的科学家领导的一个研究小组在《Science Advance》上发表题为“Transient inhibition of mTOR in human pluripotent stem cells enables robust formation of mouse-human chimeric embryos”的研究论文,研究人员将人类干细胞暂时抑制mTOR激酶三个小时,然后注射进小鼠胚泡中,小鼠胚胎会发育出数百万个成熟的人类细胞,包括红细胞,眼细胞和肝细胞。