No.1 7月30日,国家药监局官网发布了2019年度药品审评报告。其中包括以下几个方面:药品注册申请受理情况、药品注册申请审评审批情况、重点治疗领域品种、重点工作进展情况和2020年重点工作安排。
No.2 7月29日晚间,国家组织药品集中采购和使用联合采购办公室关于发布《全国药品集中采购文件(GY-YD2020-1)》的公告(国联采字〔2020〕1号)。一直备受业内瞩目的第三批国采文件正式对外公示,8月20日(星期四)将在上海开标。
No.3 7月29日,国家卫健委发布《关于抗肿瘤药物临床应用管理办法公开征求意见的公告》,对抗肿瘤药物临床使用提出明确要求。《办法》要求,对抗肿瘤药物临床应用实行分级管理。根据安全性、可及性、经济性等因素,将抗肿瘤药物分为限制使用级和普通使用级。
No.4 7月31日,国家医保局正式发布《基本医疗保险用药管理暂行办法》。《办法》对国家医保目录的制定和调整作出的明确规定,明确建立完善动态调整机制,原则上国家医保目录每年调整一次。从医保目录制定的要求来看,随着医保目录的动态调整,将有大批品种被调出医保目录。同时,一些目录外的想挤进医保目录的品种,也将从此与医保目录无缘。此外,《办法》第三十六条明确规定,原则上《药品目录》不再新增OTC药品。
二、药企动态
No.1 礼来发布2020年上半年财报:在+13%销量增长的推动下,集团全球营收113.59亿美元,同比+6%。其中糖尿病药物度拉糖肽Trulicity(+29%)、恩格列净Jardiance(+22%)、甘精胰岛素Basaglar(+10%);银屑病药物Taltz(+38%);类风湿性关节炎药物Olumiantt(+54%);癌症药物Cyramza(+13%)、Verzenio(+63%)。
辉瑞全球营收238.29亿美元,同比-10%。排除消费者健康业务,2020年上半年辉瑞同比下滑-3%。创新药物:营收100.07亿美元,同比+11%。成熟药物(普强):营收20.22亿美元,同比-37%,Lipitor、Norvasc、Lyrica、万艾可市场均受到不同程度重创。
No.2 7月27日,阿斯利康与第一三共宣布在抗体偶联药物(ADC)领域达成重磅合作。这一合作协议及金额高达60亿美元,根据协议,阿斯利康与第一三共将在全球除日本外共同开发和商业化靶向Trop-2的抗体偶联药物DS-1062,第一三共将保留在日本独家开发的权利。与此同时,阿斯利康将向第一三共支付10亿美元分期付款(协议完成时3.5亿美元,协议生效之日起12个月后3.25亿美元,协议生效之日起24个月后3.25亿美元)、药物上市后额外支付10亿美元款项,以及高达40亿美元的销售相关里程碑款项。
No.3 7月17日,赛默飞世尔和QIAGEN表示,双方已经修改了收购协议的条款,将QIAGEN股票的报价提高10%至每股43欧元(49美元),按此计算,总收购价将提高10亿欧元(11.7亿美元)。7月22日,QIAGEN发表补充声明回应。至此,赛默飞世尔对凯杰的收购案尘埃落定。
No.4 7月27日,Moderna宣布该公司开发的针对新冠病毒的mRNA疫苗(mRNA-1273)3期研究已开始向参与者给药。3期研究与美国国立卫生研究院(NIH)下属的国家过敏和传染病研究所(NIAID),以及生物医学高级研究与开发管理局(BARDA)合作进行。同日,Moderna宣布更新与BARDA的合同,后者将额外提供最高4.72亿美元的资金,以支持mRNA-1273的3期研究。此前,BARDA承诺提供4.83亿美元以支持mRNA-1273和临床开发的规模化生产,最初规划的3期临床试验的预期参与者人数较少。随着Moderna决定进行更大规模的3期临床试验,双方修改了合同条款,BARDA扩大了对mRNA-1273的后期临床开发的支持,使资助总金额约为9.55亿美元。
No.5 7月30日,北京万泰生物药业股份有限公司全资子公司厦门万泰沧海生物技术有限公司授权赛诺菲巴斯德公司进行新型轮状病毒疫苗(主要用于预防 A 型轮状病毒引起的儿童腹泻)开发、生产及商业化。交易金额:(1)预付款及里程碑款总金额 6800 万美金,其中包括 1000 万美金预付款及 5800 万美元里程碑付款;(2)商业化后视销售产品品种给予净销售额 1%或 2%的许可费。
No.6 泰格医药自7月19日通过港交所上市聆讯后,于7月28日至7月31日公开招股,8月7日挂牌。招股价在88-100港元,拟全球发行1.07亿股,集资逾100亿港元,或将成为今年内亚洲规模最大的医疗IPO。据最新券商数据显示,泰格医药首日招股额度高达408.35亿港元,超购68.35倍。
No.7 7月29日,爱博诺德(北京)医疗科技股份有限公司登陆科创板,成为中国首家完成科创板上市的眼科医疗器械企业。截止7月29日9时40分,爱博医疗本次发行股本共计2629万,每股发行价为33.55元,开盘价188.88元,最高达233.55元,涨幅超过500%。2014年,爱博医疗率先推出拥有完全自主知识产权、有高端屈光功能的可折叠非球面人工晶状体,打破了进口产品在高端人工晶状体技术和市场上的垄断局面。
No.8 7月28日晚,证监会核发4家企业科创板IPO批文,其中包括医疗健康类企业圣湘生物。招股说明书(上会稿)显示,本次科创板IPO,圣湘生物拟发行不超过4000万股,占发行后总股本比例不低于10%,募资5.57亿元。2020年3月4日,圣湘生物科创板上市申请获得受理;5月6日,上交所披露首轮问询函答复;6月23日,成功过会;7月2日,提交注册;7月28日注册生效。IPO历程顺利快速。
No.9 7月29日,证监会核发3家企业科创板IPO批文,其中包括生物医药类企业成都苑东生物制药股份有限公司。据悉,苑东生物有3个在产国内首仿产品,4个通过一致性评价产品,其中2个为首家通过一致性评价。另有多款在研药物仍然处在临床试验阶段。
No.10 7月23日晚间,深交所发布创业板上市委2020年第7次审议会议结果公告,浙江维康药业股份有限公司首发顺利过会。目前创业板注册制新规下的审批名单已经陆续出炉,医药制造、流通再次成为备受关注的一个领域。据统计,截止目前,共有19家医药制造、流通企业IPO获受理,总共募资金额超112亿。
三、药品审批
No.1 7月30日,阿斯利康宣布FDA授予Tagrisso(奥希替尼)“突破性疗法”资格,用于EGFR突变阳性早期非小细胞肺癌(IB,II和IIIA)术后的辅助治疗。奥希替尼目前主要作为EGFR突变NSCLC患者的二线疗法和一线疗法获批。
No.2 近日,南京三迭纪医药科技有限公司向美国FDA新兴技术组(Emerging Technology Team, ETT)递交了将其全球首创的热熔挤出沉积(Melt Extrusion Deposition, MED)3D打印技术加入“新兴技术项目(Emerging Technology Program, ETP)”的申请。ETT小组已回函同意了三迭纪的申请,三迭纪成为国内首家入选FDA“新兴技术项目”的医药企业。此前,三迭纪已就该产品完成了和FDA的Pre-IND会议,将于今年第四季度向FDA递交该产品的IND。FDA在2014年底启动“新兴技术项目”计划,旨在帮助和鼓励医药行业尽早实施能够提高产品质量的创新技术。
No.3 近日,默沙东宣布,FDA已授予其缺氧诱导因子-2α(HIF-2α)抑制剂MK-6482突破性疗法认定,MK-6482(原名PT2977)是一种强效、选择性、口服HIF-2α抑制剂,用于治疗von Hippel-Lindau(VHL)疾病相关的肾细胞癌(RCC)患者,这些患者携带小于3厘米大小的非转移性RCC肿瘤。FDA还授予MK-6482治疗VHL疾病的孤儿药资格。
No.4 近日,百时美施贵宝和bluebird bio公司联合宣布,已向FDA提交双方联合开发的CAR-T疗法idecabtagene vicleucel(ide-cel,又名bb2121)的生物制品许可申请(BLA)。这是一款靶向B细胞成熟抗原(BCMA)的嵌合抗原受体(CAR)T细胞免疫疗法,用于治疗复发/难治性多发性骨髓瘤(R/R MM)成人患者。本次提交提供了化学、生产和控制(CMC)模块的更多详细信息,以解决2020年3月初始BLA提交后FDA在2020年5月提出的未满足的监管要求。此前,ide-cel已获得FDA授予的突破性疗法资格,并获得欧洲药品管理局的PRIME认定。
Ide-cel的主要疗效数据
No.5 7月30日,默沙东宣布抗PD-1单抗Keytruda两项新的补充生物制品许可申请(sBLA)已获得美国FDA受理。一项sBLA寻求加速批准Keytruda联合化疗,治疗表达PD-L1(CPS≥10)的局部复发不可切除或转移性三阴性乳腺癌(TNBC)患者。另一项申请寻求批准Keytruda联合化疗,作为高危早期TNBC患者的新辅助治疗,以及单药作为手术后的辅助治疗。
No.6 近日,罗氏旗下基因泰克公司宣布,FDA批准其重磅PD-L1抑制剂Tecentriq(atezolizumab),与MEK抑制剂Cotellic(cobimetinib)和BRAF抑制剂Zelboraf(vemurafenib)联用,一线治疗携带BRAF V600突变的晚期黑色素瘤患者。Tecentriq是一种单克隆抗体,旨在与肿瘤细胞和肿瘤浸润免疫细胞上表达的PD-L1结合,阻断其与PD-1和B7.1受体的相互作用。通过抑制PD-L1介导的信号通路,Tecentriq可增强T细胞抗癌免疫反应。
No.7 近日,武田公司宣布,FDA授予其在研药物pevonedistat突破性疗法认定,用于治疗高风险骨髓增生异常综合征(HR-MDS)患者。Pevonedistat是一款“first-in-class”NEDD8激活酶(NAE)抑制剂,它有望成为十多年来首个治疗HR-MDS患者的创新药物。目前,这些患者的治疗选择仅限于低甲基化药物(HMA),即使采用已有疗法,HR-MDS患者的预后仍然不良。
No.8 7月29日,复宏汉霖发布公告称其商务合作伙伴Accord公司递交的HLX02(注射用曲妥珠单抗,欧盟商品名:Zercepac)在欧盟获批上市,用于HER2阳性的早期乳腺癌、HER2阳性的转移性乳腺癌,以及未经治疗的HER2阳性的转移性胃癌或胃/食管交界处腺癌。2019年4月,HLX02的新药上市申请(NDA)获国家药品监督管理局受理,随后被纳入优先审评审批程序。
No.9 7月28日,CDE按照优先审评范围“(五)符合附条件批准的药品”将基石药业的阿泊替尼片(avapritinib)上市申请正式纳入优先审评审批程序。阿泊替尼片是全球首款治疗携带 PDGFRA 外显子 18 突变(包括 PDGFRA D842V 突变)的不可切除或转移性胃肠间质瘤(GIST)成人患者的精准靶向药物。阿泊替尼是一款口服,在研、强效、高选择性的KIT和PDGFRA突变激酶抑制剂。美国FDA已批准avapritinib以商品名AYVAKITTM在美国销售,用于治疗携带PDGFRA外显子18突变(包括PDGFRA D842V突变)的不可手术切除或转移性GIST成人患者。
No.10 7月28日,友芝友生物提交的注射用重组抗CD38和CD3双特异性抗体(Y150 )临床申请获得CDE受理,这是首个申报临床的国产CD38/CD3双抗。Y150采用自主创新的YBODY®平台技术,一端靶向肿瘤细胞高表达的CD38抗原,另一端靶向免疫T细胞表面的CD3抗原。通过靶向CD38抗原及CD3抗原,将T细胞招募至肿瘤细胞处,并激活T细胞对肿瘤细胞进行免疫杀伤,从而抑制肿瘤细胞生长。
No.11 7月29日,辉瑞在中国提交的特应性皮炎新药克立硼罗软膏上市申请获得国家药监局批准上市。该药为国家《第二批临床急需境外新药》,适应症为2岁及以上轻度至重度特应性皮炎。辉瑞从2020年2月提交上市申请到今天获批,用时不到6个月。
No.12 7月30日,阿斯利康宣布,NMPA已正式批准耐信®针剂(注射用艾司奥美拉唑钠)用于预防重症患者应激性溃疡出血。作为原研质子泵抑制剂,注射用艾司奥美拉唑钠这一新适应证获批为我国应激性消化道出血的预防提供了又一选择。
No.13 7月29日, 歌礼制药申报的1类新药拉维达韦上市申请获得国家药监局批准,用于治疗慢性丙肝。拉维达韦是歌礼开发的第2个丙肝创新药,为新一代NS5A抑制剂,具有泛基因型、高抗病毒活性、高耐药屏障及安全性良好的特点。
No.14 7月30日,先声药业自主研发的脑血管病领域1类创新药先必新®(依达拉奉右莰醇注射用浓溶液)获NMPA批准上市。依达拉奉右莰醇从2007年立项至今,历经十三载,荣获8项发明专利,核心专利在多个国家及地区(美国、日本、澳大利亚、加拿大、欧洲、香港等)获得授权;获得2次国家科技部“重大新药创制”专项支持。
四、医药科技
No.1 7 月 29 日,以色列希伯来大学的 Yinon Ben-Neriah 团队在《Nature》上发表研究论文。该研究发现 p53 突变本身并不一定是坏事,在肠道等某些微环境中,这些突变实际上可以帮助机体抵抗癌症,而不是引发癌症。[1]
No.2 近日,美国北卡罗来纳州立大学程柯团队在《Science Advances》上发表研究论文。发现了一种可以促进毛发再生的miRNA——miR-218-5p,这一由毛乳头细胞(DP细胞)分泌的外泌体中的miRNA,可以有效促进毛囊生长,或可用于开发治疗脱发和谢顶的潜力候选药物。[2]
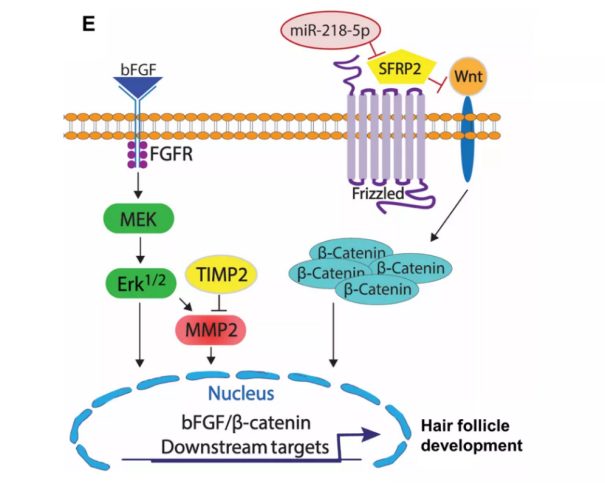
文章配图(来源:Science Advances)
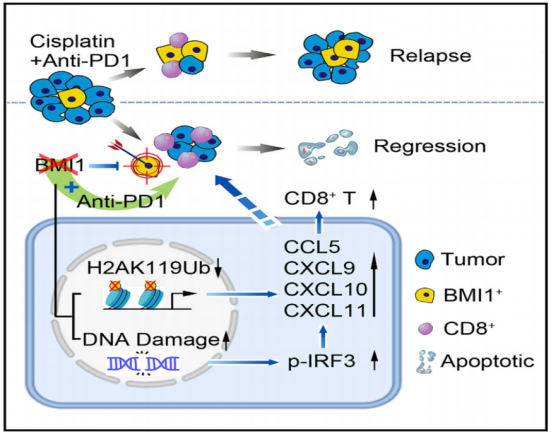
No.3 近日,中国工程院外籍院士,加州大学洛杉矶分校王存玉团队在《Cell Stem Cell》杂志发表研究论文。该研究证实BMI1阳性CSC负责HNSCC的起始、侵袭性生长和转移。靶向BMI1阳性CSC与化疗药物顺铂联用,可协同抑制HNSCC的生长,从而表明联合治疗肿瘤主体和清除CSC可以达到更好的癌症治疗效果。[3]
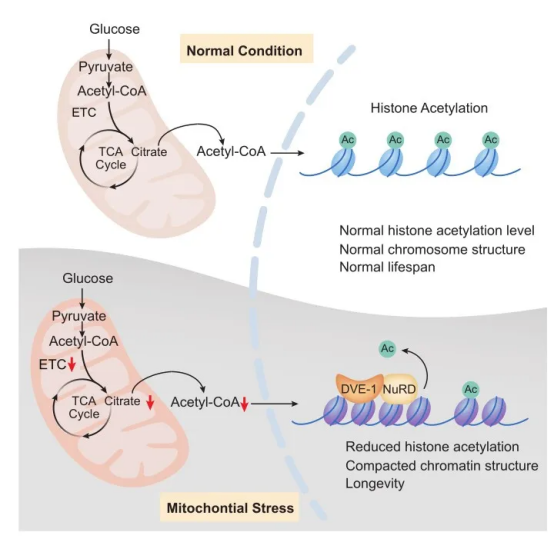
No.4 7月31日,中国科学院遗传与发育生物学研究所田烨课题组在《Science Advances》发表论文。该研究揭示了线粒体代谢物乙酰辅酶A(acetyl-CoA)通过核小体重塑与组蛋白去乙酰化(Nucleosome Remodeling and Deacetylase,NuRD)复合体,调控线粒体应激诱导长寿的分子机制。[4]
No.5 阿斯利康(AstraZeneca)宣布,该公司的SGLT2抑制剂达格列净(dapagliflozin, 英文商品名Farxiga)在治疗慢性肾病(CKD)患者的3期临床试验中,达到所有主要终点和次要终点。临床试验的结果显示,在CKD成人患者中,达格列净对复合终点产生具有统计学显著性和临床意义的改善。
No.6 艾伯维AbbVie宣布,其JAK抑制剂Rinvoq与外用皮质类固醇(TCS)联用,在治疗特应性皮炎的关键性3期临床试验AD Up中,达到了共同主要终点和所有次要终点,这是Rinvoq在治疗特应性皮炎的第三项关键性3期研究中取得积极结果。
素材来源:生物经纬