一、政策简讯
No.1 1月13日,为贯彻《药品管理法》有关规定,进一步加强药品上市后变更管理,国家药监局组织制定了《药品上市后变更管理办法(试行)》,自发布之日起施行,其中,附件1的第二章第一节提到上市许可人变更的情况。《办法》包括以下内容:药品上市后变更管理办法(试行),关于实施《药品上市后变更管理办法(试行)》的说明,《药品上市后变更管理办法(试行)》政策解读,药品上市许可持有人变更申报资料要求。
No.2 1月15日,国家药监局关于2020年医疗器械临床试验监督抽查中真实性问题的公告指出,为加强对医疗器械临床试验监督管理,申办者和临床试验机构应当严格按照《医疗器械临床试验质量管理规范》要求开展临床试验,切实落实主体责任,确保临床试验过程科学规范、结果真实可靠。
二、药企动态
No.1 赛诺菲(SNY.US)宣布与英国抗体研发公司Kymab达成一项协议,将以11亿美元的预付款收购后者,并将Kymab研发新抗体KY1005加入其产品线。据悉,KY1005用于治疗自身免疫性疾病的临床更新,在第一次临床研究中完成第24个受试者的给药。KY1005是一种完全人类单克隆抗体,是一种潜在的一流治疗,可以解决许多自身免疫病症患者潜在的免疫系统失衡。它结合OX40L并阻止其激活OX40,这是一种在免疫系统的T细胞中诱导延长的反应的蛋白质,其可导致免疫系统的疾病和对患者的损害作用。
No.2 再鼎医药(纳斯达克代码:ZLAB;香港联交所代码:9688)和Cullinan Oncology宣布,双方达成独家授权合作,以推进CLN-081在大中华区的开发、生产和商业化工作。Cullinan Oncology是一家致力于为癌症患者开发变革性靶向和免疫疗法的生物制药公司。根据协议条款,Cullinan Oncology 旗下子公司Cullinan Pearl将获得2000万美元的预付款,并有资格获得最高至2.11亿美元的开发、注册和基于销售的里程碑付款。此外,再鼎医药将根据CLN-081在大中华地区的年度净销售额,向Cullinan支付特许权使用费。再鼎医药将获得在大中华区独家开发、制造和商业化CLN-081的权利。
No.3 据上交所官网信息,日前上海联影医疗科技股份有限公司已与中信证券、中金公司签署辅导协议,正式启动科创板上市流程。成立已超九年的国产医疗器械老大哥联影医疗终于开启了上市之路,资料显示,联影医疗于2020年9月3日整体变更设立股份公司。作为一家集高端医学影像诊断产品、放射治疗产品及高端生命科学仪器的设计、研发、生产和销售为一体,并提供配套智能化、信息化解决方案的器械巨头,联影医疗已逐步掌握了高端医学影像诊断产品、放射治疗产品及高端生命科学仪器的主要核心技术,诊断产品覆盖磁共振成像系统(MRI)、计算机断层扫描系统(CT)、X射线成像系统(XR)和分子影像系统(PET/CT、PET/MR);放射治疗产品(RT)覆盖CT引导直线加速器系统及直线加速器系统、高端生命科学仪器覆盖动物用MRI及PET/CT等。
No.4 日前,国内眼科领军企业康弘药业公布一笔定增方案,拟定增募资34.72亿,主要用于其明星产品康柏西普眼用注射液国际Ⅲ期临床试验和注册上市项目。其中有19.7亿元就用于RVO/DME适应症国际III期临床试验及注册上市项目,6亿元用于开展治疗 wAMD 国际Ⅲ期临床试验及注册上市项目。
No.5 1月13日,江苏浩欧博生物医药股份有限公司在上海证券交易所成功上市。股票简称为浩欧博,股票代码为688656 。发行价格35.26元/股,当日最高价达75.88元,市值41亿元。公司专注于体外诊断领域中的过敏和自身免疫疾病诊断试剂的研发和生产,致力于为广大患者提供“用得起、用得放心”的检测产品。浩欧博产品已覆盖国内30余个省及直辖市的1700余家医疗机构。在过敏领域,公司过敏产品覆盖50余种IgE过敏原及30余种食物特异性IgG过敏原,以较好的质量和性价比在国内市场占有约30%的份额;同时,公司拓展了自身免疫性疾病检测领域,截至目前已覆盖自身免疫性疾病 40 余种检测项目,公司产品以4G对于2G产品的技术优势和性价比,已经在一定程度上对于进口企业2G产品的市场份额实现了进口替代。
No.6 欧康维视宣布以每股28.35港元公开配售2,800万股新股,国内外知名投资者积极认购,公司募集资金净额为7.83亿港元,配售及认购股份数额占公司发行新股后股本的4.52%。 本次新股发行募资款项将主要用于搭建OT-401(Yutiq)的商业营销网络,继续招募优秀的眼科商业化团队;持续推进产品线上包括OT-1001(Zerviate)、OT-301(NCX470)、OT-702(阿柏西普生物类似药)、OT-101(低浓度阿托品)及OT-202(TKI抑制剂)等在内的多项药品临床试验;同时也将用于公司继续建造苏州夏翔工厂,投资建设原料药生产基地,及其他一般用途。
No.7 1月15日,提供医疗大数据及人工智能技术解决方案的医渡科技(02158-HK)赴港上市,开盘暴涨121.5%,报58.25港元,总市值超500亿港元。招股书显示,2018-2020年,医渡云经调整净亏损人民币2.529亿元、4.193亿元和3.236亿元,依然没有摆脱互联网医疗行业的亏损通病。安永报告显示,2019年,医渡云在中国医疗大数据解决方案市场中的份额为5%,收入在中国所有医疗大数据解决方案提供商中排名第一。提供基于大数据和人工智能技术的医疗解决方案,医渡云面向医院、制药、生物技术及医疗设备公司、医生、患者等医疗行业的主要参与者。在营收层面,通过招股书可以看出,如果按照收入模块来划分,医渡云的收入主要有三块:大数据平台和解决方案收入、生命科学解决方案收入、健康管理平台解决方案收入。
三、药品审批
No.1 1月12日,Cognito Therapeutics宣布其采用Gamma射频技术开发的非侵入性神经刺激器械获得美国FDA突破性医疗器械(Breakthrough Device Designation)认定,用于治疗阿尔茨海默病相关认知和功能症状。该产品是一种促进大脑Gamma神经振荡(Gamma oscillation)的非侵入性神经刺激器械,是该公司治疗神经退行性疾病和其他慢性适应症的数字治疗管线中的首个产品。
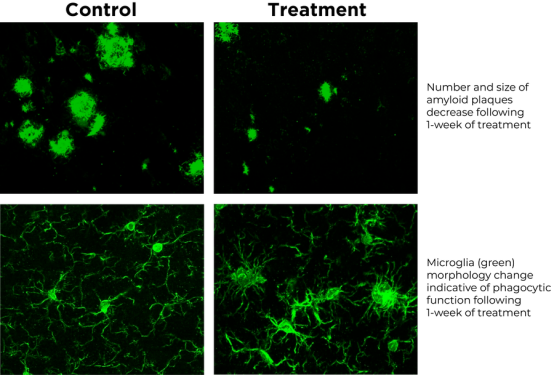
非侵入性脑刺激技术治疗1周可减少小鼠Aβ斑块数量,改善小胶质细胞功能形态
No.2 1月12日,拜耳宣布,FDA受理其在研新药finerenone的NDA申请,并授予其优先审评资格,用于治疗慢性肾病(CKD)和2型糖尿病(T2D)。Finerenone是一种潜在first-in-class非甾体、选择性盐皮质激素受体拮抗剂(MRA),能减少盐皮质激素受体(MR)过度激活的有害影响。盐皮质激素受体过度激活是肾脏和心脏损害的主要驱动因素。2015年, FDA曾授予finerenone快速通道资格(FTD)。
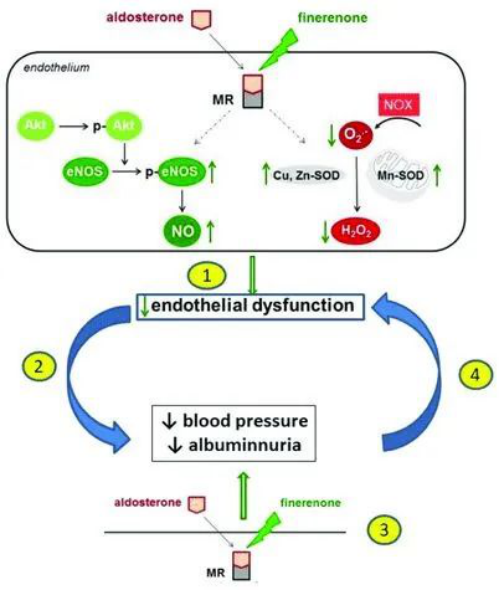
finerenone作用机制
No.3 1月12日,默沙东宣布FDA受理其在研15价肺炎球菌结合疫苗V114生物制品许可申请(BLA)并授予其优先审评资格。用于预防18岁及以上成人侵袭性肺炎球菌病。目前V114在欧盟的上市申请正在接受欧盟委员会的审查。
No.4 1月14日,辉瑞宣布,其多靶点TKI抑制剂 crizotinib(克唑替尼)新适应症获FDA批准,用于治疗1岁及以上儿童和年轻成人ALK阳性复发或难治性系统性间变性大细胞淋巴瘤(ALCL)。crizotinib是FDA批准治疗ALCL的首个生物标志物驱动的精准疗法。
No.5 1月14日,诺华宣布FDA授予其ligelizumab (QGE031)突破性疗法认定,用于治疗对H1 -抗组胺药治疗反应不足的慢性自发性荨麻疹(CSU)。Ligelizumab (QGE031)是诺华开发的下一代抗免疫球蛋白E (IgE)单克隆抗体,通过阻断IgE/FcεRI通路发挥作用,IgE/FcεRI通路是CSU中炎症过程的关键驱动因子。
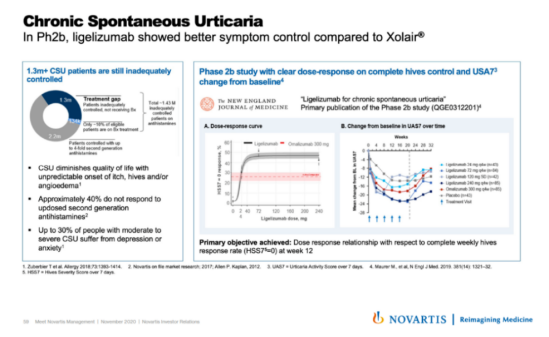
Ligelizumab的一项2b期临床试验结果
No.6 近日,辉瑞公司(Pfizer)宣布,美国FDA批准Xalkori(crizotinib)扩展适应症,用于治疗ALK阳性的系统性间变性大细胞淋巴瘤(ALCL)儿童和青少年患者。这些患者属于复发/难治性患者。这是治疗ALCL患者的首个生物标志物驱动的精准治疗手段。Xalkori是一种酪氨酸激酶抑制剂(TKI),已经在多个国家和地区获批治疗ALK阳性和ROS1阳性非小细胞肺癌。2018年获得美国FDA的突破性疗法认定,治疗ALK阳性ALCL儿童和青少年患者。
No.7 近日,FDA官网显示,已批准阿斯利康(AstraZeneca)和第一三共(Daiichi Sankyo)公司联合开发的抗体偶联药物Enhertu(fam-trastuzumab deruxtecan-nxki)扩展适用范围,用于治疗HER2阳性局部晚期或转移性胃癌和胃食管结合部(GEJ)腺癌患者。这些患者曾经接受过基于trastuzumab疗法的治疗。这是Enhertu在2019年获批治疗HER2阳性乳腺癌后斩获的第二项适应症。
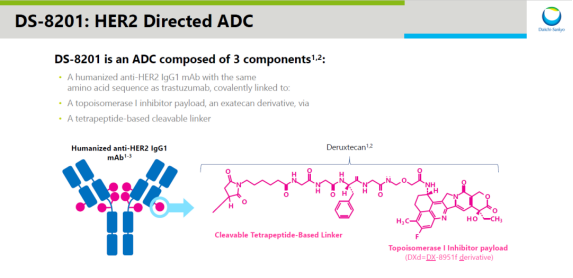
Enhertu(DS-8201)结构示意图
No.8 1月10日,CDE临床试验公示平台显示亘喜生物靶向CD19的自体CAR-T疗法GC019F获批临床,用于治疗18-70岁复发或难治性CD19+急性B淋巴细胞白血病。这是亘喜生物获批临床的第2款CAR-T疗法。
No.9 1月12日,复星凯特的CD19 CAR-T疗法益基利仑赛注射液在中国的上市申请处于“在审批”阶段,有望于近期获NMPA批准上市,会成为国内首个上市的CAR-T疗法。益基利仑赛注射液是吉利德/Kite制药开发的CD19 CAR-T细胞注射液(商品名Yescarta)。2017年10月成为FDA批准的首款针对特定非霍奇金淋巴瘤的CAR-T细胞药物。2018年8月在欧盟获批上市。
No.10 1月12日,CDE官网显示,安进交KRASG12C抑制剂sotorasib(AMG 510)临床试验申请被CDE拟纳入突破性疗法。在国内拟开发适应症为治疗既往接受过至少一种系统性治疗的携带KRAS p.G12C突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者。
No.11 1月12日,信达生物宣布NMPA已经正式受理信迪利单抗用于二线治疗鳞状非小细胞肺癌(sqNSCLC)的新适应症申请(sNDA)。此次申请为信迪利单抗在非小细胞肺癌领域第3个新适应症申请。
No.12 1月13日,NMPA正式受理信达生物PD-1抑制剂达伯舒(信迪利单抗注射液)联合达攸同(贝伐珠单抗注射液)一线治疗肝癌患者新适应症上市申请(sNDA)。此项申请为达伯舒的第5项适应症上市申请,也是达攸同的第4项适应症上市申请。
No.13 近日,绿叶制药集团宣布,其自主研发的注射用利培酮微球(Ⅱ)(瑞欣妥®)已获得中国国家药品监督管理局的上市批准,用于治疗急性和慢性精神分裂症以及其他各种精神病性状态的明显的阳性症状和明显的阴性症状,可减轻与精神分裂症有关的情感症状。瑞欣妥®为注射用缓释微球制剂,是中国首个自主研发、开展全球注册的、具有自主知识产权的创新微球制剂。
No.14 1月13日,复星医药发布公告称其子公司复宏汉霖收到国家药监局临床批件,同意其研制的重组抗 CD38 全人单克隆抗体注射液( HLX15)开展治疗多发性骨髓瘤临床试验。
No.15 1月14日,百济神州宣布其替雷利珠单抗注射液第3项适应症获得NMPA批准(受理号:CXSS2000014),适应症为联合化疗(紫杉醇/白蛋白紫杉醇+卡铂)一线治疗晚期鳞状NSCLC。
No.16 1月15日,国家药监局官网显示协和发酵麒麟株式会社布罗舒单抗(burosumab)(受理号:JXSS1900056、JXSS1900057、JXSS1900058)已获NMPA批准上市。用于治疗X连锁显性遗传低磷性佝偻病(XLH)。Burosumab于2018年4月获得美国FDA批准上市,成为全球首个获批治疗1岁及以上儿童和成人的XLH的药物,2019年10月,扩大适用人群至6个月以上儿童患者。又于2020年10月获批治疗肿瘤性骨软化症。此前,FDA曾授予该药突破性疗法认定和孤儿药资格。
四、医药科技
No.1 近日,清华大学常智杰教授实验室与北京大学人民医院合作,在《Nature Communications》发表题为“CREPT is required for murine stem cell maintenance during intestinal regeneration”的研究论文。CREPT 是常智杰教授实验室克隆的一个肿瘤基因,它能够促进肿瘤生长和细胞增殖,并在多种癌组织中高表达。已经发表多篇论文表明 CREPT 是一个潜在的肿瘤靶向治疗标志基因。这项工作首次证明了缺失 CREPT 的肠上皮细胞在受到损伤后无法再生,确定了 CREPT 基因对Lgr5+肠干细胞的重要调控作用,为探索结直肠癌的发病机制提供了理论基础。
No.2 1月6日,美国约翰霍普金斯大学Sidney Kimmel综合癌症中心的研究人员在《Cancer Discovery》发表了题为“A pro-carcinogenic colon microbe promotes breast tumorigenesis and metastatic progression and concomitantly activates Notch and β catenin axes”的研究论文。这项研究在小鼠模型中发现,一种通常与结肠炎和结肠癌有关的微生物——产肠毒素脆弱拟杆菌(ETBF)可以在乳腺和肠道定植,迅速诱导乳腺上皮增生,并促进了乳腺癌的发生和转移进程。
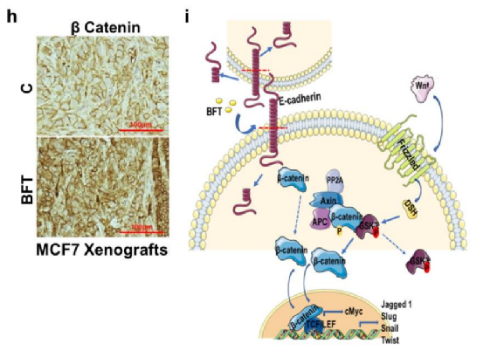
文章配图(来源:Cancer Discovery)
No.3 1月13日,约翰·霍普金斯大学的研究人员在《Science Translational Medicine》发表了题为“Enhanced drug delivery to the reproductive tract using nanomedicine reveals therapeutic options for prevention of preterm birth”的研究论文。该研究发现,通过工程化纳米载体递送组蛋白脱乙酰基酶(HDAC)抑制剂进行阴道递送,能够有效预防早产。此外,在体外人子宫肌层细胞中,黄体酮/HDAC抑制剂组合通过增加孕激素受体B的稳定性,既抑制细胞收缩又促进黄体酮的抗炎作用。
No.4 1月12日,上海交通大学医学院附属仁济医院上海市肿瘤研究所覃文新研究员和上海交通大学附属上海市胸科医院姜丽岩教授合作,在《Nature Communications》发表了题为“circNDUFB2 inhibits non-small cell lung cancer progression via destabilizing IGF2BPs and activating anti-tumor immunity”的研究论文。该研究通过高通量筛选非小细胞肺癌的癌与癌旁组织circRNAs表达谱,首次探究了circNDUFB2在非小细胞肺癌发展中的功能及作用机制。
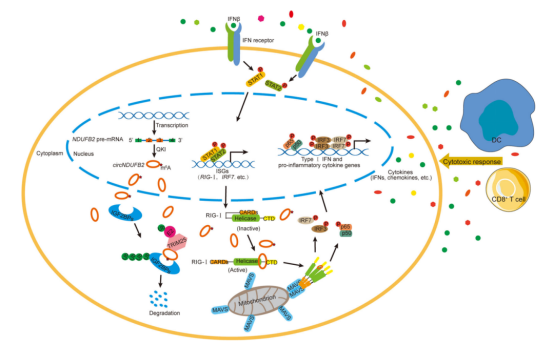
文章配图(来源:Nature Communications)
No.5 1月11日,中国医学科学院北京协和医学院黄波教授团队在《Nature Immunology》发表了题为“IL-2 regulates tumor-reactive CD8+ T cell exhaustion by activating the aryl hydrocarbon receptor” 的研究论文。这项研究发现肿瘤微环境中的 IL-2 可诱导 CD8+ T 细胞耗竭,进而抑制抗肿瘤免疫反应。
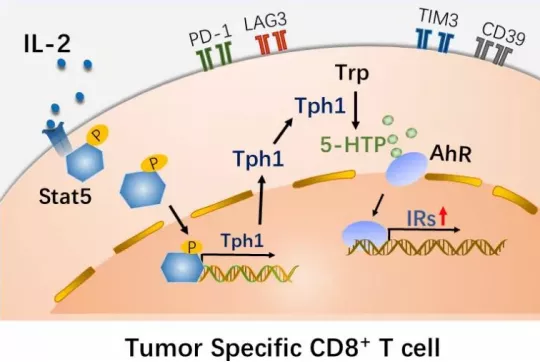
文章配图(来源:Nature Immunology)
No.6 1月13日,强生公司在《新英格兰医学期刊》发表研发的腺病毒新冠疫苗的I/IIa期临床试验的中期结果。该疫苗采用的是人源腺病毒血清型26(Ad26)载体,携带编码全长且稳定的新冠病毒S蛋白。这项中期分析表明,Ad26.COV2.S疫苗在年轻人(18-55岁)和老年人(65岁及以上)中均具有安全性和免疫原性。这一结果与之前的临床前结果相结合,支持了继续进行两项3期临床试验试验(NCT04505722和NCT04614948),以评估低剂量单剂注射或两剂注射方案的疗效(低剂量为5×10E10病毒颗粒/ml)。
No.7 1月12日,罗氏(Roche)宣布即将在本月举行的美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)上正式报告其PD-L1抑制剂泰圣奇(Tecentriq)联合抗VEGF疗法安维汀(Avastin)(以下简称“T+A”方案),在一线治疗晚期肝癌患者的3期临床试验IMbrave150中的总生存期(OS)最新结果。数据显示,“T+A”方案治疗的患者中位总生存期为19.2个月,其中中国亚群患者的中位总生存期达到24.0个月。
