一、政策简讯
No.1 4月15日,国家药监局药审中心关于发布《用于产生真实世界证据的真实世界数据指导原则(试行)》的通告(2021年第27号),本指导原则将从真实世界数据的定义、来源、评价、治理、标准、安全合规、质量保障、适用性等方面,对真实世界数据给出具体要求和指导性建议。
No.2 4月15日,国家药监局关于发布基于同类治疗药物的肿瘤伴随诊断试剂说明书更新与技术审查等5项注册技术审查指导原则的通告(2021年第24号)。
其中,《基于同类治疗药物的肿瘤伴随诊断试剂说明书更新与技术审查指导原则》适用于有明确科学结论表明适用于同类治疗药物的肿瘤检测试剂,简化相关试剂说明书预期用途要求,合理评估试剂安全性及有效性;
《实时荧光PCR分析仪注册技术审查指导原则》适用于基于实时荧光PCR检测技术进行定性或定量检测的实时荧光PCR仪,适用于全自动设备的扩增部分,不适用于其他非实时荧光PCR扩增原理的核酸分析仪,也不适用于数字PCR仪;
《轮状病毒抗原检测试剂注册技术审查指导原则》适用于以抗原抗体反应为原理,对人粪便样本或其他适用样本中的轮状病毒进行体外定性检测的试剂,临床用于急性胃肠炎患者轮状病毒感染的辅助诊断;
《B群链球菌核酸检测试剂注册技术审查指导原则》适用于基于实时荧光PCR(Real-time polymerase chain reaction)检测方法的GBS核酸检测试剂;
《人细小病毒B19 IgM/IgG抗体检测试剂注册技术指导原则》适用于结合临床表现和其他实验室指标,用于急性及慢性人细小病毒B19感染的辅助诊断及免疫状态的评估和急性及慢性感染患者抗体的血清学转换的判定。
No.3 4月15日,国家药监局关于发布重组胶原蛋白类医疗产品分类界定原则的通告(2021年第27号),本原则规定的重组胶原蛋白类医疗产品是指以重组胶原蛋白为主要成分,以医疗为目的的产品。重组胶原蛋白类产品的管理类别应当不低于第二类;重组胶原蛋白类产品作为无源植入物应用时,应当按照第三类医疗器械管理;重组胶原蛋白类产品作为止血和防黏连材料应用时,若产品可部分或全部被人体吸收或者用于体内时,按照第三类医疗器械管理;若产品不可被人体吸收且仅用于体表时,按照第二类医疗器械管理;重组胶原蛋白类产品作为医用敷料应用时,若产品可部分或者全部被人体吸收,或者用于慢性创面,按照第三类医疗器械管理;若产品不可被人体吸收且用于非慢性创面,按照第二类医疗器械管理,重组胶原蛋白类产品的分类编码应当根据产品的预期用途,参照《医疗器械分类目录》予以确定。
二、药企动态
No.1 赛默飞世尔科技公司近日宣布,它将以每股现金47.50美元的价格收购临床研究服务提供商PPD,总价格为174亿美元,加上假设净债务约为35亿美元,这证实了最近有交易的传闻。该公司表示,该交易较PPD在4月13日的收盘价溢价约24%,预计将于今年年底完成。据赛默飞世尔(Thermo Fisher)称,此次收购将使它成为临床研究服务行业的“全球领导者之一”,预计该领域将长期以个位数增长。去年,PPD的收入为47亿美元。
No.2 4月15日,默沙东公布两条重要临床试验进展变更信息:1)终止免疫调节剂MK-7110(此前称作CD24Fc)治疗COVID-19项目的进一步开发,2)终止口服抗病毒药物molnupiravir(EIDD-2801/MK-4482)在重症住院患者中的II/III期研究,继续推进molnupiravir在门诊轻中度患者中的III期研究。CD24Fc由华人免疫学家刘阳教授此前创办的昂科免疫(OncoImmune)研发。2020年9月24日,昂科免疫公布了III期临床中期数据,203例患者的治疗数据表明,CD24-Fc可以降低死亡率超过50%。2020年12月,默沙东以4.25亿美元完成对昂科免疫的收购,并获得这款治疗COVID-19潜在药物,并希望将其开发为重症住院患者的其中一个治疗选择。
No.3 总部位于巴黎的赛诺菲收购位于美国马萨诸塞州的生物技术公司Tidal Therapeutics,此交易的总额达到4.7 亿美元。根据该协议条款,赛诺菲先期支付1.6亿美元,此后另外支付3.1亿美元的各种里程碑付款。这家来自剑桥LabCentral的生物技术公司Tidal Therapeutics专注于开发能够传递信使RNA(mRNA)的纳米颗粒,该信使RNA可对免疫细胞进行重新编辑。该公司正在致力于开发用于肿瘤学和免疫疾病的技术。
No.4 4月16日,北京百普赛斯生物科技股份有限公司首发申请获创业板上市委员会通过,将于深交所创业板上市。公司首次公开发行的股票不超过2000.00万股,占发行后总股本的 25.00%。据招股书显示,百普赛斯拟募集资金9.37亿元,此次募集的资金将用于研发中心建设、营销服务升级、补充流动资金等项目。公司主要产品及服务应用于肿瘤、自身免疫疾病、心血管病、传染病等疾病的药物早期发现及验证、药物筛选及优化、诊断试剂开发及优化、临床前实验及临床试验、药物生产过程及工艺控制(CMC)等研发及生产环节。
No.5 4月13日,北京诺禾致源科技股份有限公司正式以“688315”为股票代码在科创板挂牌上市,成为“NGS科研服务第一股”。根据公开发售数据显示,诺禾致源本次公开发行新股4020万股,发行价12.76元/股,新股募集资金总额约5.13亿。上市当日,市值超100亿元。
No.6 4月15日,上交所披露受理益方生物科技(上海)股份有限公司科创板IPO申请,益方生物拟在科创板募资24.09亿元,由中信证券担任保荐机构。益方生物由王耀林等多位海归博士联合创办,研发思路是从化合物与靶点的结合构象出发设计药物,目前产品管线中共有9款产品,其中1款处在新药上市申请(NDA)阶段,3个处于临床试验阶段以及5个临床前在研项目,目标适应症覆盖非小细胞肺癌、乳腺癌、结直肠癌等肿瘤,以及高尿酸血症及痛风等代谢疾病。
三、药品审批
No.1 4月12日, FibroGen宣布美国FDA已授予该公司抗-CTGF单抗pamrevlumab快速通道资格认定(FTD),用于治疗杜氏肌营养不良症(DMD)。FDA此次资格授予是基于对一项针对非门诊DMD患者开展的II期单臂临床研究结果的审查,FDA认为pamrevlumab有潜力解决该疾病尚未满足的医疗需求。Pamrevlumab目前正在开展治疗DMD的2项III期临床研究。2019年4月FDA授予Pamrevlumab治疗DMD孤儿药资格。除了开展治疗DMD研究以外,Pamrevlumab还被开发用于治疗局部晚期不可切除胰腺癌和特发性肺纤维化。这3个适应症临床研究均已处于III期临床阶段。
Pamrevlumab作用机制
No.2 4月13日,吉利德宣布,FDA已加速批准靶向Trop-2的抗体偶联药物(ADC)sacituzumab govitecan (Trodelvy) 的sBLA申请。用于治疗此前接受过铂类化疗和PD-1/L1抑制剂治疗的局部晚期或转移性尿路上皮癌(mUC)。4月7日,Trodelvy用于接受过两次或两次以上全身治疗,不可切除的局部晚期或转移性三阴性乳腺癌(TNBC)适应症已获得FDA完全批准。
No.3 4月13日, vTv Therapeutics 宣布,其在研新型每日口服1次葡萄糖激酶激活剂TTP399已获得FDA授予的突破性疗法认定,作为胰岛素辅助疗法,用于1型糖尿病的治疗。
No.4 4月16日,百时美施贵宝宣布,美国FDA批准PD-1抑制剂Opdivo (纳武利尤单抗)与化疗联用,作为晚期或转移性胃癌、胃食管连接部(GEJ)癌和食管腺癌的初始治疗。这是FDA批准的首个一线治疗胃癌的免疫疗法。
No.5 4月13日,药监局披露医疗器械批准证明文件(进口)待领取信息,包括一款进口的“注射用聚己内酯微球面部填充剂”产品,推测应为华东医药委托CRO公司申报注册的“少女针”Ellanse。
No.6 近日,先声药业发布公告,其创新药管线产品SIM-307已获得国家药监局签发的药物临床试验批准通知书。SIM-307是基于诺贝尔奖成果水通道学说开发出的一种水通道蛋白4(AQP4)抑制剂,作为脑水肿领域全新作用机制的小分子first-in-class新药,通过静脉方式给药,拟用于治疗急性重症缺血性卒中并发脑水肿。
No.7 4月15日,CDE官网显示,辉瑞Lorlatinib片(劳拉替尼)上市申请已获国家药监局受理。劳拉替尼最早于2018年11月在美国获FDA加速批准上市,用于二线治疗ALK阳性转移性NSCLC患者,这些患者既往接受过克唑替尼和至少一种其他ALK抑制剂的治疗。并于今年3月5日获批第2项适应症,用于一线治疗ALK阳性NSCLC。
No.8 4月15日, Biogen开发的富马酸二甲酯肠溶胶囊 (dimethyl fumarate) 已获国家药监局批准上市。用于包括临床孤立综合征、复发缓解型、活动性继发进展型复发型多发性硬化成年患者的治疗。
No.9 4月16日,成都先导发布公告,该公司创新药注射用HG381的临床试验申请已获得国家药监局默认许可,拟开展治疗晚期实体瘤临床研究。该产品是首个在中国获批开展临床试验的针对STING靶点的非核苷酸类激动剂。也是成都先导第3个获得临床试验许可的新药项目。另两个项目分别为HG030片(ROS1/NTRK双靶点抑制剂)、HG146(HDAC I/IIb亚型选择性抑制剂)。
No.10 4月11日,荣昌生物在国内率先发布全球首个用于治疗系统性红斑狼疮(SLE)的双靶标生物新药泰爱(通用名:泰它西普)。
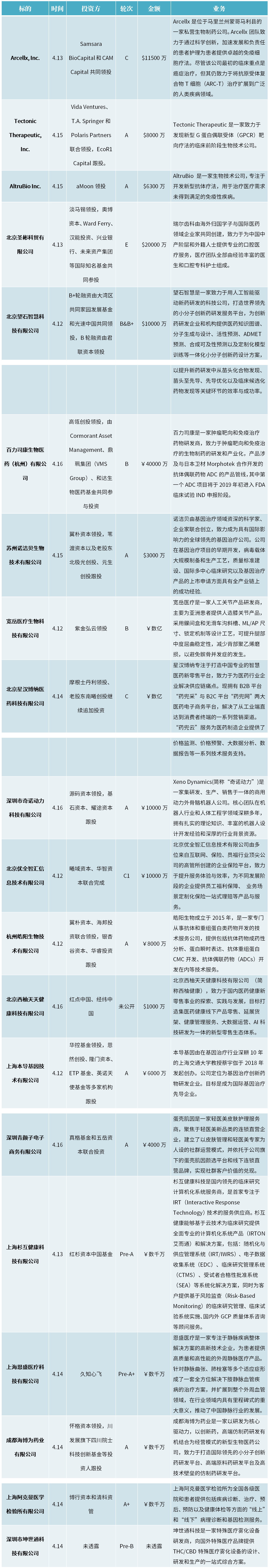
四、投融资
五、医药科技
No.1 4月16日,沈阳药科大学孙进团队在《Science Advances》发表题为“Apoptotic body–mediated intercellular delivery for enhanced drug penetration and whole tumor destruction”的研究论文,该研究首先提出并证明凋亡小体(ApoBDs)可以在细胞凋亡后将剩余的药物携带到邻近的肿瘤细胞中。这种协同方法可以克服邻近效应的局限性,以深入穿透实体瘤以破坏整个肿瘤。
No.2 4月14 日,天津医科大学总医院神经内科刘强教授团队在《Science Translational Medicine》杂志发表了题为“Brain injury instructs bone marrow cellular lineage to reduce neuroinflammation”的文章。通过分析脑出血病人去骨瓣减压手术取得的骨髓细胞,研究团队发现脑出血快速激活骨髓造血干细胞(Hematopoietic stem cells, HSCs)。结合 micro-PET 成像、基因编码和谱系示踪等技术,团队进一步发现脑出血后机体通过神经支配,导致骨髓在短时间内生成具有免疫调节功能的单核细胞,这些新生的单核细胞可迁移到脑内病灶,抑制神经炎症和血肿周围脑水肿。
文章配图(来源:Science Translational Medicine)
No.3 4月15日,上海市精神卫生中心-中科院上海药物研究所联合实验室周子凯研究员与南京医科大学生殖医学国家重点实验室、病原生物学系季旻珺教授合作,在神经科学顶级期刊 《Nature Neuroscience》发表了题为“Rescue of maternal immune activation-induced behavioral abnormalities in adult mouse offspring by pathogen-activated maternal Treg cells”的研究论文。该研究建立了母体免疫激活(MIA)的新型疾病动物模型,揭示了MIA影响子代免疫系统并造成孤独症相关表型的机制,并发现可以通过调节成年期子代小鼠的免疫系统改善其孤独症的表型。
文章配图(来源:Nature Neuroscience)
No.4 4月9日,澳大利亚Victor Chang心脏研究所的研究人员在《Science》发表了题为“Krüppel-like factor 1 is a core cardiomyogenic trigger in zebrafish 的研究论文。该研究发现,Klf1”基因是斑马鱼心脏损伤修复的关键,作为一种遗传开关,在心脏损伤后启动心肌细胞增殖,进而修复受损心脏。这一发现提供了开启人类心脏再生能力的线索,有望开启人类心脏再生,挽救心脏病患者的生命。
文章配图(来源:Science)
No.5 4月13日,清华大学免疫学研究所董晨院士团队在《Immunity》发表了题为“Interleukin-17D regulates group 3 innate lymphoid cell function through its receptor CD93”的研究论文。该研究首次鉴定了IL-17D的功能性受体为CD93,并揭示IL-17D通过结合CD93调节ILC3细胞的功能并参与维持肠道稳态。
文章配图(来源:Immunity)
No.6 近日,中国医学科学院肿瘤医院王洁教授和上海交通大学附属胸科医院陆舜教授领衔,联合国内15家医院及百济神州,在《JAMA Oncology》发表了题为“Tislelizumab Plus Chemotherapy vs Chemotherapy Alone as First-line Treatment for Advanced Squamous Non–Small-Cell Lung Cancer A Phase 3 Randomized Clinical Trial”的三期临床试验论文。该论文公布了百济神州研发的替雷利珠单抗联合化疗对比化疗用于一线治疗晚期鳞状非小细胞肺癌患者的3期临床试验数据(clinicaltrials.gov 登记号:NCT03594747)。研究结果表明,替雷利珠单抗联合化疗是晚期鳞状非小细胞肺癌患者合适的一线治疗选择。
No.7 近日,TG Therapeutics公司宣布,其创新糖工程化抗CD20抗体ublituximab在两项3期临床试验中达到主要终点。在名为ULTIMATE I和ULTIMATE II的两项随机双盲,含活性对照的3期临床试验中,复发型MS患者接受了ublituximab或teriflunomide的治疗。试验结果显示,在接受治疗96周后,ublituximab将患者的疾病年复发率降低到0.10以下。与活性对照组相比,将年复发率分别降低60%和49%,达到试验的主要终点。
来源:Retrieved
素材来源:生物经纬