一、政策简讯
No.1 6月18日,国家药监局关于发布《已上市生物制品变更事项及申报资料要求》的通告(2021年第40号),本通告自发布之日起实施。通告指出:
一、国家药品监管部门审批的补充申请事项包括:(一)国家药品监管部门发布的已上市生物制品药学变更相关技术指导原则中属于重大变更的事项;(二)国家药品监管部门发布的已上市生物制品临床变更相关技术指导原则中属于重大变更的事项;(三)药品上市许可持有人主体变更;(四)使用药品商品名;(五)国家药品监管部门规定需要审批的其他事项。
二、国家或省级药品监管部门备案事项(境内生产生物制品报持有人所在地省级药品监管部门备案,境外生产生物制品报国家药品监督管理局药品审评中心备案)(一)国家药品监管部门发布的已上市生物制品药学变更相关技术指导原则中属于中等变更的事项;(二)国家药品监管部门发布的已上市生物制品临床变更相关技术指导原则中属于中等变更的事项;(三)改变不涉及技术审评的药品注册证书载明事项;(四)境外生产药品分包装及其变更;(五)国家药品监管部门规定需要备案的其他事项。
三、年报事项包括:(一)国家药品监管部门发布的已上市生物制品药学变更相关技术指导原则中属于微小变更的事项;(二)国家药品监管部门发布的已上市生物制品临床变更相关技术指导原则中属于微小变更的事项;(三)国家药品监管部门规定的需要年报的其他事项。
No.2 6月15日,国家药监局 海关总署关于增设长春空港口岸为药品进口口岸的公告,有关事宜公告如下:一、自本公告发布之日起,除《药品进口管理办法》(以下简称《办法》)第十条规定的药品外,其他进口药品(包括麻醉药品、精神药品)可经由长春空港口岸进口;二、增加吉林省药品监督管理局为口岸药品监督管理部门,由其承担长春空港口岸药品进口备案的具体工作;三、增加吉林省药品检验研究院为口岸药品检验机构。自本公告发布之日起,吉林省药品检验研究院开始承担长春空港口岸的药品口岸检验工作。
二、药企动态
No.1 据IPO早知道消息,本周又一家细胞治疗独角兽Lyell Immunopharma(下称Lyell)登陆美股。临床前实体瘤生物技术公司Lyell于6月17日晚间在纳斯达克上市,代码为LYEL,今晨收盘市值为39亿美元。 除了细胞治疗三巨头Juno、Kite和诺华之外,同赛道的Sana(SANA.US)、Allogene(ALLO.US)和Lyell都堪称后起之秀。Sana和Allogene的市值分别为42.88亿美元和34.95亿美元。相似的是,后三家年轻的公司都有强大的创始团队,因此也受到生物医药领域知名基金青睐。Sana的创始人兼CEO来自Juno;而Allogene的创始人兼CEO来自Kite。 ARCH Venture Partners、GSK、Foresite Capital、Gemini Investments、Milky Way Investments是Lyell的主要股东,高瓴、红杉中国也分别是Lyell的A轮、C轮投资人。 Lyell的目标是开发针对任何癌症的基于治疗性细胞的免疫疗法,重点是CAR-T和实体瘤。虽然细胞治疗的研发取得了很多进展,但进展集中在血液肿瘤,而大多数癌症却是实体瘤癌症。
No.2 6月17日,FibroGen, Inc.(纳斯达克:FGEN)与深耕免疫调节机理及以单细胞技术见长的临床阶段跨国生物制药公司HiFiBiO Therapeutics(高诚生物),共同宣布达成了一项涵盖三个在研项目的合作。根据协议条款,FibroGen将向高诚生物支付2,500万美元首付款,以及行使选择权时的付款。此外,未来高诚生物有望获得关于这三个项目在行使选择权、临床、注册和商业化方面总计金额最高可达11亿美元的里程碑付款。高诚生物还将有资格获得基于产品全球净销售额的特许权使用费。
No.3 6月17日,华盛顿,丹纳赫公司(Danaher,NYSE: DHR)宣布已达成最终协议以约96亿美元的现金价格收购私人持有的 Aldevron。丹纳赫预计使用手头现金和/或发行商业票据的收益为收购提供资金。Aldevron由Michael Chambers和John Ballantyne于1998年创立,总部位于北达科他州法戈,拥有约600名员工。Aldevron生产高质量的质粒 DNA、mRNA和蛋白质,为研究、临床和商业应用的生物技术和制药客户提供服务。Aldevron将作为丹纳赫生命科学部门的独立运营公司和品牌运营。
No.4 6月17日,卫材(Eisai)和百时美施贵宝 (BMS)宣布,两家公司已达成共同开发和商业化抗体偶联药物(ADC) MORAb-202的全球独家战略合作协议。根据协议,两家公司将在日本、中国、亚太地区国家、美国、加拿大、欧洲(包括欧盟、英国、俄罗斯)地区共同开发和商业化MORAb-202。BMS将全权负责合作区域以外地区药物开发和商业化。Eisai将继续负责MORAb-202的全球生产和供应。根据协议的财务条款,BMS将向Eisai支付6.5亿美元,其中2亿美元用于支付Eisa的研发费用。Eisai也有权获得高达24.5亿美元的潜在未来开发、监管和商业里程碑付款。双方将在合作区域内分享利润、研发和商业化成本,BMS将向Eisai支付合作区域外销售的特许权使用费。Eisai预计将在日本、中国、亚太地区国家、欧洲和俄罗斯销售MORAb-202。BMS预计将在美国和加拿大销售MORAb-202。
No.5 6月18日,CAR-T细胞疗法领域领导者科济药业正式在港交所上市,共计发行9474.7万股,每股发售股份定价为32.80港元,募得款项净额约为29.40亿港元。今年3月,FDA批准了第5款CAR-T细胞疗法,加剧了资本对于CAR-T赛道玩家的青睐。根据近期Nature子刊的报告,当前全球已有超2000条细胞治疗管线,其中大多数为CAR-T疗法,尽管美国处于领导者地位,但是中国市场的发展也不容小觑。其中,升级版靶向B细胞成熟抗原(BCMA)的CAR-T产品CT053为科济药业唯一核心候选产品,也是成熟度最高的候选产品,先后获得美国FDA的RMAT和孤儿药认定,EMA的PRIME和孤儿药产品认定,以及国家药监局的突破性治疗药物品种认定。1期临床结果显示,该产品对于复发╱难治性多发性骨髓瘤(R/R MM)具有良好的安全性。
图片源自招股书
No.6 据IPO早知道消息,生物制药公司和誉生物于6月16日晚间向港交所递交招股说明书,拟主板挂牌上市,摩根士丹利和摩根大通担任联席保荐人。成立于2016年的和誉生物主要寻求发现和开发治疗癌症及其他疾病的新型、差异化疗法,从而满足中国和全球患者未获满足的迫切需求,现已战略性地设计和开发由14个项目组成并专注于肿瘤学的项目组成的管线,包括四项处于临床阶段的产品。
No.7 上海谊众招股书(上会稿)显示,本次上海谊众计划发行不超过2645万股人民币普通股,拟募集资金10.33亿元,用于投入建设年产500万支注射用紫杉醇聚合物胶束及配套设施项目(4.28亿元),注射用紫杉醇聚合物胶束扩大适应症临床研究项目(2.06亿元),营销网络建设 项目(1亿元)以及补充流动资金及业务发展资金(3亿元)上海谊众成立于2009年,致力于抗肿瘤药物改良型新药的研发及产业化,核心产品是注射用紫杉醇聚合物胶束(下称“紫杉醇胶束”),拟申请注册用于非小细胞肺癌的一线化疗。此次冲击IPO,上海谊众采用了科创板第五套上市标准,适用《上海证券交易所科创板股票发行上市审核规则》第二十二条第二款第(五)项规定的上市标准。
三、药品审批
No.1 6月15日亚盛医药宣布,公司在研原创新药Bcl-2抑制剂APG-2575的临床试验申请获美国食品药品监督管理局(FDA)临床试验许可,将展开单药或与抗癌药物联合治疗晚期ER+乳腺癌或实体瘤的研究。该研究是一项全球多中心、开放性、Ib/II期临床研究,旨在评估APG-2575单药治疗晚期实体瘤患者,或联合CDK4/6抑制剂palbociclib治疗CDK4/6抑制剂治疗后进展或复发的ER+/HER2-转移性乳腺癌患者的安全性、耐受性、PK特征及初步疗效。
No.2 6月16日,天津天药药业股份有限公司宣布,其子公司天津金耀药业有限公司获得注射用甲泼尼龙琥珀酸钠的新药简略申请(ANDA,即美国仿制药申请),意味着可以生产并在美国市场销售该产品。
No.3 6月15日,三生国健发布公告,双特异抗体SSGJ-705治疗晚期或转移性HER2表达阳性实体瘤患者的 I 期、多中心、开放标签、首次人体临床试验获得美国食品药品管理局 (FDA)批准。这是三生国健首个申报临床的双抗,该产品目前还未在国内申报临床。
No.4 6月16日,广东众生药业发布公告,收到美国专利商标局颁发的专利证书,发明名称为FGFR4 INHIBITOR AND PREPARATION METHOD AND USE THEREOF,中文名为:FGFR4抑制剂及其制备方法和应用。专利号:11,008,292,专利到期时间为2037年11月16日。
No.5 6月16日,石药集团发布公告,本集团开发的抗体药物偶联物(Antibody-Drug Conjugate) SYSA1801已获得国家药品监督管理局批准,可开展于中国的临床研究。该产品在国内外已提交多件专利申请。
No.6 国家药品监督管理局通过优先审评审批程序批准罗氏制药公司申报的1类创新药利司扑兰口服溶液用散(商品名:艾满欣)上市,该品种为儿童罕见病治疗药品,适应症为2月龄及以上患者的脊髓性肌萎缩症(SMA)。
No.7 6月17日,CDE官网显示,赛诺菲/再生元度普利尤单抗(Dupixent)第3项适应症上市申请拟纳入优先审评并开始公示。用于治疗外用处方药控制不佳或不建议使用外用处方药的≥6岁至<12岁儿童和成人中重度特应性皮炎患者。本品可与或不与外用皮质类固醇联合使用。
No.8 6月17日,CDE官网显示,勃林格殷格翰IL-36R单抗Spesolimab(BI655130注射液)获国家药监局拟突破性疗法认定,用于治疗泛发性脓疱型银屑病(GPP)。
No.9 近日,国家药监局官网显示,百济神州PD-1抗体药物百泽安(替雷利珠单抗)2项新适应症上市申请(受理号:CXSS2000032、CXSS2000033)已处于“在审批”阶段,将于近期获得NMPA批准。
No.10 近日,百济神州宣布,泽布替尼胶囊(百悦泽)新适应已获得国家药品监督管理局附条件批准。用于治疗成人华氏巨球蛋白血症(WM)患者,在中国取得第3项适应症的批准,以及针对华氏巨球蛋白血症在全球的第2项批准。
No.11 近日,国家药监局官网显示,复星凯特靶向CD19自体嵌合抗原受体(CAR)T细胞疗法阿基仑赛注射液(axicabtagene ciloleucel)在中国的上市申请(受理号:CXSS2000006)处于“在审批”阶段,有望于近期获NMPA批准上市,将会是国内首个获批上市的CAR-T疗法。
No.12 6月21日,国家药监局官网显示,和黄医药索凡替尼胶囊新适应症(受理号:CXHS2000028)已获得NMPA批准,用于治疗晚期胰腺神经内分泌瘤患者。
No.13 6月21日,国家药监局官网显示,阿斯利康奥拉帕利片新适应症已获得NMPA批准。根据受理号,此项获批适应症可能为携带BRCA1/2突变(胚系和/或体细胞系)且在既往新型激素药物治疗后出现疾病进展的转移性去势抵抗性前列腺癌成人患者的单药治疗。
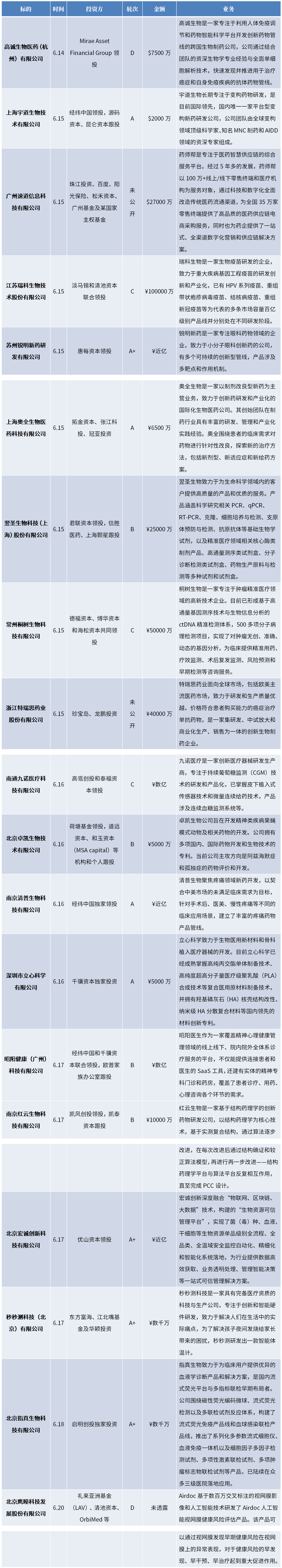
四、投融资
五、医药科技
No.1 6月16日,美国哥伦比亚大学的研究人员联合新加坡国立大学、芝加哥大学等在《Nature》上发表题为“Structural basis of omega-3 fatty acid transport across the blood–brain barrier”的研究论文。该研究描述了一种将Omega-3运输到大脑中的分子工作机制,可能是解锁血脑屏障的关键,可以帮助研究人员开发出能够更好地穿过血脑屏障的神经疾病药物。
MFSD2A 介导的转运机制(来源:nature)
No.2 6月16日,上海第二军医大学(海军军医大学)刘玉环和张荣佳,在预印本《bioRxiv》发表了题为“A rat model of pregnancy in the male parabiont”的研究论文。该研究成功构建了雄性连体大鼠,并让雄性大鼠成功怀孕并诞下后代。
No.3 6月11日,徐州医科大学肿瘤生物治疗研究所饶恩于教授等在《Science Immunology》发表了题为“All-trans retinoic acid overcomes solid tumor radioresistance by inducing inflammatory macrophages”的研究论文。该研究发现,全反式维甲酸(ATRA)联合消融性放射疗法,可以产生一个炎症性巨噬细胞和T细胞抗肿瘤免疫的正反馈回路,从而具有更好的肿瘤治疗效果。
文章配图(来源:Science Immunology)
No.4 6月8日,南京医科大学药学院江苏省心脑血管药物重点实验室主任季勇教授团队在心血管领域顶级期刊《Circulation》发表题为“Histidine triad nucleotide binding protein 1 attenuates cardiac hypertrophy via suppressing Homeobox A5 expression”的研究论文。在这项研究中,季勇教授团队首次发现,HINT1能够延缓心肌肥厚的进程。心肌细胞中的HINT1能够与PKCb1相互结合,抑制PKCb1的膜转位,下调 PKCb1的磷酸化水平,抑制下游的MEK/ERK/YY1信号通路,从而抑制同源盒基因A5(HOXA5)的表达及其下游的TGF-b信号通路,最终延缓心肌肥厚的进程。
文章配图(来源:Circulation)
No.5 6月15日,Sage Therapeutics和渤健 (Biogen)联合宣布,针对重度抑郁症(MDD)患者的潜在“first-in-class” 口服药物zuranolone (SAGE-217/BIIB125)在3期临床试验中达到了主要终点。这是一种新一代γ-氨基丁酸(GABAA)受体别构调节剂。在第15天时,通过17项汉密尔顿抑郁量表(HAMD-17)评估,与安慰剂相比,zuranolone使患者抑郁症状获得统计显著且具有临床意义的减轻(p=0.0141)。
No.6 近日,赛诺菲(Sanofi)公司宣布,其潜在“first-in-class”补体C1s蛋白抑制剂sutimlimab在治疗冷凝集素病(CAD)患者的关键性3期临床试验中达到主要终点,能够迅速并且持续抑制CAD患者中C1激活导致的溶血,它同时为患者的血红蛋白水平和疲惫提供具有临床意义的改善。赛诺菲计划在今年下半年向美国FDA递交生物制品许可申请(BLA)。